La microscopia a fluorescenza supera se stessa, l’invisibile diventa visibile
Le tecniche dei Nobel per la chimica del 2014 mettono a fuoco le nuove frontiere della biologia cellulare su scala nanometrica
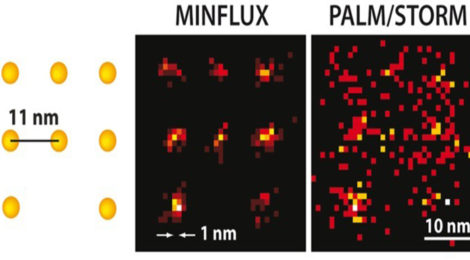
Si chiama Minflux (Minimal emission Fluxes) ed è la nuova frontiera della microscopia a fluorescenza. Arriva a osservare in maniera distinta singole molecole molto vicine l’una all’altra, in modo più rapido ed emettendo un minor numero di fotoni rispetto alle tecniche precedenti. Il nuovo microscopio, realizzato dal biochimico tedesco Stefan Hell insieme ai colleghi dell’Istituto Max Plank di chimica biofisica a Göttingen, raggiunge la massima risoluzione oggi possibile e nasce dalla combinazione dei risultati delle ricerche che valsero la vittoria del Nobel per la chimica nel 2014 allo stesso Hell, insieme agli americani Eric Betzing e William Moerner, “per lo sviluppo della microscopia a fluorescenza in super risoluzione”.
Le tecniche di microscopia a fluorescenza, studiate da Hell, Betzing e Moerner, hanno consentito di valicare quel limite teorizzato nel 1873 dallo scienziato tedesco Ernst Abbe, secondo cui non sarebbe mai stato possibile osservare un oggetto di dimensioni più piccole dello 0,2 milionesimo di metro (siamo nell’ordine di circa la metà della lunghezza d’onda della luce).
I primi passi li muove Hell nel 1994, ideando il cosiddetto metodo Sted. La microscopia ad “emissione stimolata” (Stimulated Emission Depletion) consiste nell’utilizzo di due raggi laser: uno che accende le molecole fluorescenti disposte sul campione, l’altro, a forma di ciambella, che elimina la fluorescenza non compatibile alla scala nanometrica attorno al campione. La tecnica Sted consente di definire la precisa posizione della molecola, tuttavia il fascio laser non è abbastanza forte da limitare l’effetto della fluorescenza alla singola unità molecolare.

Stefan Hell in laboratorio.
Credits: Google immagini
Contestualmente, gli americani Betzing e Moerner studiano il metodo di microscopia a singola molecola, Palm-Storm, che sfrutta l’accensione e lo spegnimento dei fluorofori in posizioni casuali e per singola molecola, ricavando la massima risoluzione dalla sovrapposizione delle immagini ottenute. In questo caso non sarebbe però possibile rilevare facilmente l’esatta posizione di ciascuna unità osservata.
L’intuizione che ha condotto alla realizzazione di Minflux è stata quella di combinare i punti di forza delle due tecniche. Analogamente alla microscopia per singola molecola, la stimolazione a fluorescenza accende e spegne le molecole in modo casuale e contestualmente, sfruttando un fascio di luce a ciambella come nel metodo Sted, si determina l’esatta posizione. La svolta sta nel fascio di luce a ciambella, che qui eccita la fluorescenza consentendo di visualizzare il punto in cui si trova la molecola.
“Sono convinto che i microscopi Minflux hanno il potenziale per diventare uno degli strumenti fondamentali della biologia cellulare”, spiega Hell, “Sarà possibile mappare le cellule nel dettaglio molecolare e osservare i rapidi processi al loro interno in tempo reale. Questo potrebbe rivoluzionare la nostra conoscenza dei processi che avvengono nelle cellule viventi”.
Credits immagine in evidenza: physicsworld.com















Commenti recenti