Un mondo dentro di noi
di Cristina Nocella, Vittoria Cammisotto, Roberto Carnevale e Francesco Violi
Theodor Escherich (1851–1911) e Henry Tissier (1866–1926) sono stati due pediatri, rispettivamente tedesco e francese. Ilya Metchnikov (1846–1916) è stato il vincitore del premio Nobel nel 1908 e Alfred Nissle (1874-1965) un microbiologo tedesco. Che cosa hanno in comune?
Certamente il fatto di essere quattro riconosciuti scienziati europei ma, in particolare, di essere i pionieri della ricerca scientifica sulla flora intestinale. Le ricerche iniziali sul microbioma intestinale (MI) risalgono infatti al 1840. I primi lavori svolti da Escherich, Tissier, Metchnikov e Nissle hanno avuto un ruolo chiave nella definizione delle basi scientifiche e delle implicazioni cliniche dei microrganismi trovati nel MI. Più di un secolo dopo gli sviluppi tecnologici hanno gettato una nuova luce sulla complessità del microbioma umano e, soprattutto, sul suo ruolo nella fisiopatologia di molte malattie.
Già alla fine del 1880 la “teoria dei germi”, come causa di malattia, era ampiamente accettata in ambito medico. I batteri responsabili di colera, antrace e tubercolosi erano stati già identificati; tuttavia, la definizione del ruolo dei batteri presenti nel tratto intestinale e in altre aree del corpo, in soggetti sani, era ancora inconcludente. Primo fra tutti Theodor Escherich, che aveva studiato il colera nell’epidemia di Napoli del 1884, fu fortemente preoccupato dagli alti tassi di mortalità causati da infezioni gastrointestinali durante i primi mesi di vita. La ricerca di Escherich culminò in due opere che hanno segnato una svolta nella comprensione del concetto di flora intestinale umana. Nei suoi trattati Escherich descrive con rigore scientifico la composizione batterica intestinale dei neonati e i cambiamenti che essa subisce dalla nascita fino all’età adulta. In particolare, definisce le implicazioni cliniche della flora intestinale (Farré-Maduell E, Human Microbiome Journal 2019).
Dopo queste prime evidenze scientifiche la mole di studi pubblicati, soprattutto negli ultimi dieci anni, fornisce ulteriormente la prova del rapporto tra MI e salute dell’uomo.
Considerando l’interazione simbiotica del microbiota con l’ospite, si può definire l’ospite e i microrganismi che lo abitano come un “superorganismo” che svolge funzioni immunitarie e metaboliche. Ad esempio, i batteri intestinali sono i principali regolatori della digestione lungo il tratto gastrointestinale, svolgono un ruolo importante nella sintesi e nell’assorbimento di molti nutrienti e metaboliti e nella funzione delle cellule immunitarie.
Bisogna sottolineare che, se da un lato queste funzioni benefiche del MI a vantaggio dell’ospite sono preservate tra gli individui, dall’altro il MI di ognuno è caratterizzato da una specifica combinazione di specie batteriche, dovuta a variazioni inter-individuali e intra-individuali che si verificano durante il corso della vita.
La composizione qualitativa e quantitativa del MI varia nei diversi tratti dell’apparato digerente. Numerosi sono, poi, i fattori che possono influenzare questa composizione, ad esempio l’alimentazione, lo stile di vita, l’esercizio fisico, l’uso degli antibiotici e anche la genetica. Lo squilibrio del MI conduce alla cosiddetta “disbiosi intestinale”, una condizione che può favorire l’insorgenza di diverse patologie, comprese le malattie metaboliche, come l’obesità e il diabete, e le malattie cardiovascolari.
La relazione tra disbiosi e rischio d’insorgenza di patologie cardiovascolari è dovuta a due fattori: la produzione di tossine, innescata dalla disbiosi stessa, e la distruzione dell’integrità strutturale e funzionale della barriera intestinale. Questa condizione consente la traslocazione di endotossine, componenti e metaboliti microbici nel sistema circolatorio, inducendo risposte immunitarie e infiammazione sistemica.
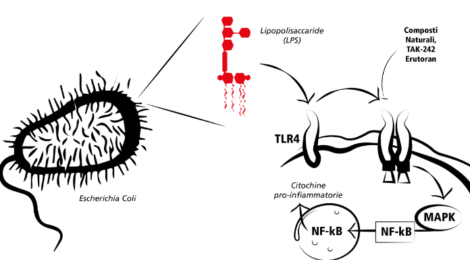
Tra i batteri più pericolosi della flora intestinale, i Gram-negativi, come i Bacteroides, contengono grandi quantità di lipopolisaccaridi (LPS), che sono glicolipidi presenti sulla membrana esterna dei suddetti batteri. L’LPS è uno degli stimoli pro-infiammatori più abbondanti ed è un potente attivatore del recettore Toll like receptor 4 (TLR4), espresso in moltissime cellule come macrofagi e piastrine. Il legame tra l’LPS e il suo recettore innesca una risposta infiammatoria e l’espressione e la secrezione di citochine.
In un recente lavoro è stato dimostrato che i livelli di LPS e della zonulina, un marcatore di alterata permeabilità intestinale, aumentano in pazienti con infarto del miocardio. Inoltre, i trombi coronarici di questi pazienti hanno mostrato concentrazioni più elevate di LPS da E. coli e positività per il TLR4 a conferma della alterazione della barriera intestinale, che si traduce nella traslocazione di LPS nella circolazione umana con aumento del rischio di eventi cardiovascolari (Violi F, EHJ 2020). È evidente che i meccanismi attraverso i quali il microbiota regola il metabolismo dell’ospite sono molto complessi e probabilmente, ad oggi, non si conoscono tutte le vie metaboliche coinvolte. La via di segnalazione attivata dal legame dell’LPS batterico al TLR4 svolge sicuramente un ruolo importante nell’innescare la risposta immunitaria innata, ma la segnalazione del TLR4 non regolata potrebbe interrompere l’omeostasi immunitaria dell’ospite, mediante una prolungata secrezione di citochine e chemochine proinfiammatorie, diventando la principale protagonista di disturbi infiammatori cronici e acuti che sono alla base di numerose patologie, tra cui quelle riguardanti il sistema cardiovascolare come l’aterosclerosi. Considerando il ruolo patologico dei TLR4 nelle malattie infiammatorie, gli inibitori della segnalazione del TLR4 potrebbero essere utili nel trattamento di queste patologie diventando potenziali strategie terapeutiche. Tra le molecole in fase preclinica o clinica di sviluppo, che sono attive nell’inibire i percorsi mediati dal TLR4, si hanno composti a basso peso molecolare di origine naturale e sintetica che possono essere considerati punti di partenza per lo sviluppo di farmaci.
Sostanze e composti farmacologicamente attivi possono essere forniti dal metabolismo secondario delle piante. La medicina tradizionale cinese e indiana utilizza una varietà di erbe ricche di molecole che agiscono come modulatori del TLR4. Tra i composti naturali si annoverano la Berberina, un alcaloide estratto principalmente da Rhizoma Coptidis, Sparstolonin B, isolato da un’erba di origine cinese (Sparganium stoloniferum), componente bioattiva della Rhizoma Atractylodis macrocephalae. Tutti questi possono essere considerati composti promettenti per sviluppare farmaci capaci di bloccare efficacemente la segnalazione LPS/TLR4 in diversi punti e di conseguenza sopprimere la cascata infiammatoria che ne conseguirebbe.
Molti antagonisti del TLR4 sono stati sviluppati recentemente. Tuttavia, solo TAK-242 (Resatorvid) ed Eritoran hanno raggiunto gli studi clinici e, tra i due, solamente TAK-242 è entrato a far parte di un trial clinico. TAK-242 è un derivato del cicloesene, è una piccola molecola con una specifica e selettiva funzione inibitoria della segnalazione del TLR4. Infatti, TAK-242 inibisce la produzione di mediatori infiammatori, indotti da LPS, legandosi al dominio intracellulare del TLR4. In particolare, studi clinici hanno evidenziato sicurezza ed efficacia del TAK-242 rendendolo clinicamente disponibile (Kuzmich NN, Vaccines 2017).
La relazione tra microbiota, ospite e predisposizione all’insorgenza di malattie rappresenta, sicuramente, un abito della ricerca scientifica ampio e non ancora del tutto esplorato. Pertanto, la sfida scientifica, che sicuramente potrà aprire in un futuro prossimo nuovi scenari, è quella di caratterizzare ulteriormente il microbiota, studiare come può influenzare la fisiologia dell’ospite favorendo i suoi aspetti regolatori positivi e minimizzando quelli potenzialmente dannosi.
Immagine in evidenza: Rappresentazione schematica della modulazione degli effetti di Escherichia coli attraverso composti naturali e sintetici che inibiscono la segnalazione del TLR4. ©Mattia La Torre

















Commenti recenti